问题:
(1)普通初中化学课程标准(实验)注重“三维目标”的落实,根据上述教材片段内
容,你认为主要的目标是:
①知识与技能目标________________;
②过程与方法目标________________;
③情感态度价值观目标________________;
(2)该片段的教学重点是________________,完成这一内容的教学采用最主要的教学方法是________________。
(3)按字母编号完成上述表格中对应的离子方程式:
(a)________________;
(b)________________;
(c)________________;
(4)将Fe、Cu与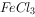 、
、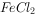 、
、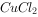 溶液放在同一容器中,分别在下列情况下,哪些离子(不考虑阴离子)或金属单质能同时存在。
溶液放在同一容器中,分别在下列情况下,哪些离子(不考虑阴离子)或金属单质能同时存在。
①反应后,若Fe有剩余,则不可能有________________存在;
②反应后,若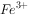 有剩余,则不可能有________________存在;
有剩余,则不可能有________________存在;
③反应后,若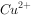 和Cu有剩余,则不可能有________________存在。
和Cu有剩余,则不可能有________________存在。
、


















)








 3
3 甲基苯酚
甲基苯酚 2
2




、


















)








 3
3 甲基苯酚
甲基苯酚 2
2



